Opgelet!
Voer dit experiment enkel uit in een laboratorium op school onder begeleiding van een leerkracht. Volg nauwgezet alle veiligheidsinstructies op. Draag steeds beschermende kledij, handschoenen en een labobril tijdens deze proef. Bescherm ook de ondergrond met voldoende folie of plastic.
Wat heb je nodig?
Opgelet: voor de proefjesvideo gebruiken we waterstofperoxide 30% i.p.v. 8% om duidelijker het resultaat te tonen. Waterstofperoxide 30% is best een gevaarlijke stof. Daarom raden we aan om voor 8% te gaan. Een iets minder spectaculair resultaat, maar wel veiliger om te gebruiken in de klas.
- Grote erlenmeyer of maatcilinder
- 30 ml waterstofperoxide 8%
- 10 ml afwasmiddel
- 0,5 g kaliumjodide
- Paar druppels voedingskleurstof (optioneel)
- Labojas, beschermende handschoenen, veiligheidsbril
- Beschermende folie
- (Periodiek systeem)

Aan de slag!
Stap 1: Doe het waterstofperoxide, het afwasmiddel en de kleurstof in de erlenmeyer.
Stap 2: Zet de erlenmeyer op een ondergrond bedekt met beschermende folie. Straks ga je het kaliumjodide toevoegen aan de erlenmeyer. Wat zou er gebeuren, denk je?
Stap 3: Voeg het kaliumjodide toe aan de erlenmeyer.
Stap 4: Probeer de stoffen eens neer te schrijven als chemische formule. Een periodiek systeem kan je daarbij helpen. Hoe zou de chemische reactie eruitzien, denk je?
Wat gebeurt er?
Het onstabiele waterstofperoxide wordt in sneltempo omgezet in water en zuurstof. De zeep‘vangt’ het zuurstofgas in miljoenen zeepbelletjes. Het schuim ontsnapt uit de fles zoals tandpasta uit een tube, maar dan met een volume dat voldoende is voor een olifant om z’n tanden mee te poetsen!
Hoe zit dat?
Kaliumjodide (KI) versnelt het proces waarbij waterstofperoxide (H2O2) wordt omgezet in water (H2O) en zuurstofgas (O2). Op zeer korte tijd komt er veel zuurstofgas vrij. Dat zuurstofgas vormt belletjes in het zeepsop met overvloedige schuimvorming tot gevolg.
De reactievergelijking ziet er als volgt uit:
H2O2 + I- –> H2O + OI-
H2O2 + OI- –> H2O + O2 + I-
KI is een zout dat in oplossing voorkomt als de ionen K+ en I-. Waterstofperoxide reageert met I-. Omdat het I– ion netto de reactie versnelt en niet weg reageert, noemen wetenschappers KI een‘katalysator’.
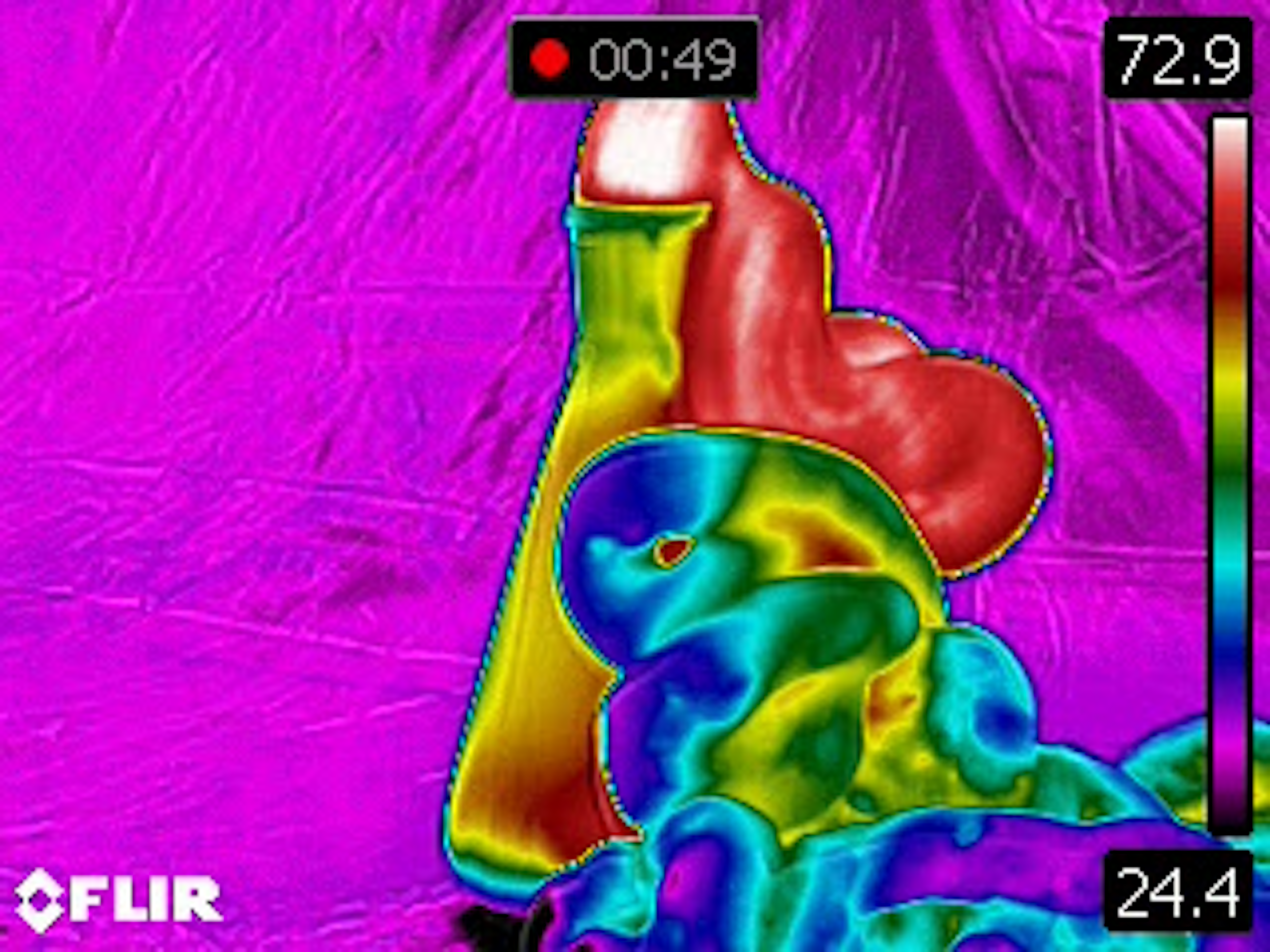
Trouwens, er komt heel wat warmte vrij bij deze‘exotherme’ reactie. Kijk maar eens naar de beelden die we met onze infraroodcamera maakten: op een gegeven moment bereikt het schuim een temperatuur van meer dan 70°C! Toch maar niet je tanden mee poetsen, dus.
Waar kom je dat nog tegen?
Een katalysator is dus een stof die een chemische reactie versnelt, zonder dat de stof daarbij zelf verbruikt wordt. Ook in ons lichaam zitten katalysatoren. Enzymen noemen we die. Die zijn nodig om energie uit ons voedsel te halen.
Ben je leerkracht?
- Terug naar overzicht
- Terug naar overzicht
- Terug naar overzicht
- Terug naar overzicht
- Terug naar overzicht
- Terug naar overzicht
- Terug naar overzicht
- Terug naar overzicht
- Terug naar overzicht
- Terug naar overzicht
- Terug naar overzicht






